Галактоземия - GALT мутации
Главна информация
Галактоземия е заболяване с автозомно-рецесивно предаване, характеризиращо се с нарушаване на метаболизма на галактозата с поява на усложнения, които могат да застрашат живота на новороденото 5 .
Галактозата е компонент на лактоза, гликолипиди, гликопротеини и протеогликани; метаболизмът му се осъществява главно на нивото на черния дроб и бъбреците. Превръщането на галактоза в глюкоза включва следните стъпки (вижте фигура 1):
- фосфорилиране на галактоза с образуването на галактоза-1-фосфат, реакция, която се извършва с помощта на галактокиназа;
- прехвърляне на остатъка от галактозил в UDP-глюкоза под действието на UDP-глюкоза-галактоза-1-фосфат-уридил-трансфераза (GALT);
- взаимното превръщане между глюкоза и галактоза се осъществява на нивото на нуклеозид-дифосфати, включва обръщане на стереохимичната конфигурация на 4 'хидроксилната група и се катализира от UDP-глюкоза-4-епимераза; този етап допринася за регенерацията на UDP-глюкоза и по този начин осигурява непрекъснатостта на цикъла на метаболизъм на галактозата.
Полученият глюкозо-1-фосфат може да бъде изомеризиран в глюкозо-6-фосфат, който играе важна роля в процеса на гликолиза и биосинтеза на инозитол.
Галактозата може да се превърне в галактитол под действието на алдозна редуктаза, в присъствието на NADPH (или NADH), което е алтернативен път на метаболизъм на галактоза при пациенти с галактоземия. Може също да се окисли под действието на галактоза дехидрогеназа, което води до образуването на галактонова киселина и CO2 1 .
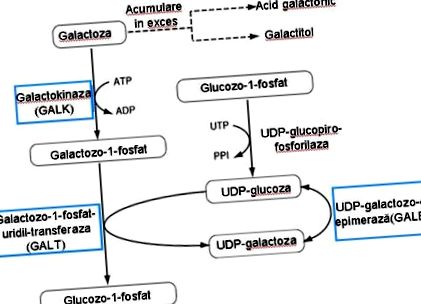
Фиг. 1 Метаболизъм на галактозата (път на Лелоар)
Хипергалактоземията се свързва с 3 ензимни дефицита:
- тип I (GALT) - модификация на ензимната активност на галактоза-1-фосфат-уридил-трансфераза (GALT), която е отговорна за наследствената галактоземия и е най-честият ензимен дефицит;
-тип II (GALK1) - модификация на ензимната активност на галактокиназа, която превръща галактозата в галактоза-1-фосфат; това е рядък дефицит;
-тип III (GALE) - модификация на ензимната активност на уридин-дифосфат-глюкоза-4-епимераза, която епимеризира UDP галактозата до UDP глюкоза и също е необичайна 3 .
| Тип | Ген | локус | Ензим | Име |
| 1 | GALT | 9p13 | галактоза-1-фосфат трансфераза уридилат | Класическа галактоземия |
| 2 | GALK1 | 17q24 | галактокиназа | Дефицит на галактокиназа |
| 3 | GALE | 1p36-p35 | UDP-галактоза-4-епимераза | Дефицит на UDP-галактоза-4-епимераза |
Хетерозиготите (генотип G/N, N е нормалният алел) са асимптоматични, показващи наполовина на ензимната активност в сравнение с хора без мутации 3; 5 .
Генът, кодиращ GALT ензима, е разположен на късото рамо на хромозома 9 и е съставен от 11 екзона (вж. Фигура 2). Установени са повече от 180 генни мутации; редица от 8 болестотворни мутации (G) често се срещат при пациенти с класическа галактоземия. Най-често срещаната е 6-точкова мутация на екзон, която кара глутаминът да бъде заменен с аргинин (Q188R; p.Gln188Arg) и който е отговорен за 60-70% от случаите на заболяване при кавказците. Мутация S135L (стр. Ser135Leu), който определя заместването на серин с левцин, е най-често срещаният сред чернокожите популации, свързан с над 50% от случаите на заболяване при тази категория хора. Мутация K285N (p.Lys285Asn), който причинява заместване на лизин с аспарагин в екзон 9, се нарежда на второ място по честота при алели, свързани с болест при кавказците (28%). Мутация L195P (p.Leu195Pro), който замества левцин с пролин, е регистриран в 5-7% от случаите на класическа галактоземия 6; 7 .
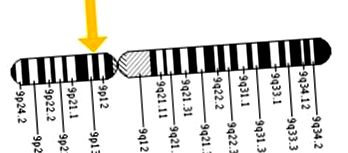

Фиг. 2 Местоположение на гена GALT върху хромозома 9
В допълнение към класическата форма съществува вариантът на Duarte на галактоземия - асимптоматично състояние или придружено от леки клинични прояви - в резултат на частично увреждане на ензима GALT. Този вариант се характеризира със сложна хетерозиготност за класически G алел, който причинява значително намаляване на GALT и алел Duarte D-2 (D2; понякога наричан D), който предизвиква частично увреждане на GALT. Хемолизатите от пациенти с галактоземия GALT показват средно ензимна активност на
25%, въпреки че са описани големи индивидуални вариации. При електрофореза с изоелектрично фокусиране се получава характерен аспект на променена подвижност на GALT изоензима. Предишни проучвания показват, че алелите D носят мисенс мутация стр. N314D (c.940A> G), който определя заместването в позиция 314 на аспарагин с аспарагинова киселина. Фенотипите на Duarte (D/N, D/D и D/G) показват съответно приблизително 75, 50 и 25% от нормалната активност на GALT и се срещат с преобладаване от около 6% сред бялата популация. Заместването N314D е напълно отговорно за промяната на ензимната подвижност, но не обяснява частичното увреждане на GALT активността. Нещо повече, тази мутация се среща и върху алелите на Duarte-1 (D1, наричан още Лос Анджелис или LA), които свързват нормална или повишена ензимна активност, поради което се считат за общ вариант или полиморфизъм на гена GALT. Последващи проучвания на алели D1 и D2 показват, че N314D се намира в дисбаланс на свързване с други варианти на нуклеотидни последователности и те се различават между D1 и D2.
По този начин алелите D1 специфично показват промяна на c.652C> T нуклеотиди, която причинява тихо заместване при кодон 218 (CTA → TTA, p.L218, понякога наричан още L218L), докато алелите D2 показват заличаване 5 'от 4 bp на промотора (c.-119_-116delGTCA) заедно с 3 модификации на интронни бази. Както алелите D1, така и D2 също носят обширна последователност от нуклеотиди А на нивото на интрон 10. Разликата между двата алела по отношение на GALT ензимната активност отдавна е предмет на противоречие. Неотдавнашно проучване показва съществуването на намалена експресия на иРНК при алела D2, което допринася за нарушена GALT функция; освен това делецията на 5 ’4 bp на промотора би представлявала причинно-следствена мутация в галактоземия на Duarte 2 .
Дефицит на галактокиназа (тип II) може да се подозира при хора с катаракта, галактоземия и повишена екскреция на галактитол с урината, но няма други клинични прояви.
Разпространението на дефицита на GALK е неизвестно, но вероятно е по-малко от 1: 100 000. Откриването на ниско ниво на галактозокиназна активност е важен елемент при установяването на диагнозата, но потвърждението се прави чрез подчертаване на мутации в гена, кодиращ ензима.
Той може да бъде ограничен до еритроцити и левкоцити и е свързан с развитието на катаракта, но не причинява забавяне на растежа, умствена изостаналост или увреждане на черния дроб.
Прилагането на лактоза при бременни жени с дефицит на галактокиназа може да причини фетална катаракта 5 .
Дефицит на UDP-галактоза-4-епимераза (GALE) (тип III) трябва да се подозира при хора с чернодробно заболяване, невросензорна глухота, свързана с повишени нива на еритроцитни галактоза-1-фосфат и нормални нива на GALT. Диагнозата се установява въз основа на откриването на ниско ниво на активност на UDP-галактоза-4-епимераза и се потвърждава чрез подчертаване на мутации в гена, кодиращ ензима. Дефицитът на UDP-галактоза-4-епимераза се оценява на 1: 23000 в Япония и е неизвестен при други популации 3; 5 .
Галактоземията е състояние, което може да бъде открито чрез неонатален скрининг. Clinitest е най-простият скринингов тест и се основава на определяне на галактоза в проба от урина. Извършва се 24-36 часа след приложението на препарат, съдържащ лактоза. В някои страни тестът се използва от капка кръв, събрана върху стандартизирана филтърна хартия (карта на Guthrie), която определя общата галактоза (галактоза и галактоза-1-фосфат) и/или активността на GALT ензима. При деца с висок риск галактоза-1-фосфатът може да се определи от кръв, събрана от пъпната връв. Идеален скринингов тест е този, който измерва активността на GALT 3; 5 .
Препоръки за генетично изследване
Генетичното тестване за GALT мутации се използва за потвърждаване на диагнозата галактоземия при деца с положителен неонатален скрининг. Също така е полезно за разграничаване на алели Duarte D2 от алели LA.
По този начин генетичното тестване определя генотипа и позволява да се установи прогнозата.
Тестването на близки роднини за асимптоматичен статус на носител може да се извърши след генетично консултиране и само след идентифициране на мутации, причиняващи заболяването в семейството. Тъй като галактоземията се предава автозомно рецесивно, родителите на дете с класическа галактоземия са задължително хетерозиготни за мутант G алел и неговите асимптомни братя и сестри имат 2/3 риск да бъдат носители на G алела. % от превозвачите.
Понастоящем братята и сестрите на дете с Duarte галактоземия имат 25% риск от D/G галактоземия, ако родителите имат D/N и G/N генотипове и 25% риск от класическа G/G галактоземия, ако родителите имат D/G генотипове. G и G/N; поради тази причина генетичното изследване на родителите е оправдано.
Пренаталната диагноза за фетуси с 25% риск от класическа галактоземия (G/G) е възможна чрез анализ на ДНК, извлечена от фетални клетки, получена чрез амниоцентеза, обикновено извършвана на приблизително 15-18 гестационна седмица или биопсия на хорионни вили, на около 10-12 гестационна седмица. И в тези случаи G алелите в семейството трябва да бъдат идентифицирани предварително 5 .
Събран образец - кръвта ще дойде 4 .
Контейнер за прибиране на реколтата - вакуутан, съдържащ EDTA като антикоагулант 4 .
Количество реколта - 5 ml кръв 4 .
Причини за отхвърляне да опиташ - използване на хепарин като антикоагулант; коагулирани или хемолизирани проби 4 .
Тествайте стабилността - 7 дни при 2-8ºC 4 .
Метод - пълно секвениране на GALT гена + анализ на MLPA делеции/дублирания; могат да бъдат открити и двете мутации, свързани с класическата галактоземия и вариантите на Duarte 1 .
Докладване и интерпретиране на резултатите
Мутациите, открити в гена GALT и съответния генотип, ще бъдат съобщени 4 .
Библиография
1. Дейвид Л. Нелсън, Майкъл М. Кокс. Гликолиза, глюконеогенеза и Пентозен фосфатен път. В Lehninger Principles of Biochemistry, пето издание, 2008, W. H. Freeman and Company, 545-546.
2. Аманда Е. Карни, Ребека Д. Сандърс, Кери Р. Гарза, Лий Ан Макгаха, Лора Дж. Бийн, Брадфорд У. Кафе, Джеймс У. Томас, Дейвид Дж. Кътлър, Натали Л. Курткая, Джудит Л. Фридович- Кийл. Произход, разпространение и експресия на алела Duarte-2 (D2) на галактоза-1-фосфат уридилилтрансфераза. В Human Molecular Genetics, 2009, том 18, № 9, 1624-1632.
3. Gerard T Berry, George A Anadiotis, дефицит на галактоза-1-фосфат уридилтрансфераза (галактоземия) www.emedicine.medscape.com, Тип справка: Интернет комуникация.
4. Лаборатория Синево. Специфични препратки към използваната работна технология през 2010 г. Тип на справка: Каталог.
5. Луис Елзас II. Галактоземия. Gene Reviews, 2000, www.ncbi.nlm.nih.gov. Референтен тип: Интернет комуникация.
6. Клиника Майо, Медицински лаборатории Майо. Справочни лабораторни услуги за здравни организации. Анализ на гена на галактоземия, известна мутация. www.mayomedicallaboratories.com. 2010. Ref Type: Интернет комуникация.
7. OMIM (онлайн наследяване на Мендел в човека). Галактоза-1-фосфат уридилилтрансфераза. http://www.ncbi.nlm.nih.gov. Референтен тип: Интернет комуникация.
8. Валериу Попеску, Алис Антрасиан, Андрей Замфиреску. Неонатален скрининг при генетични метаболитни заболявания. В Revista Romana de Pediatrie, том LVIII, nr.4, 2009.
- Гликиран хемоглобин (Hb A1c) - Synevo
- Фосфор в урината - Synevo
- Окултно кървене във фекалиите - Synevo
- Непоносимост към лактоза - медицински изследвания - Synevo
- Непоносимост към лактоза (генетичен тест) - Synevo